 Forum für Lebensverlängerung
»
Radikale Lebensverlängerung, Sport, Verschiedenes
»
Radikale Lebensverlängerung
»
Epigenetische Reprogrammierung
Forum für Lebensverlängerung
»
Radikale Lebensverlängerung, Sport, Verschiedenes
»
Radikale Lebensverlängerung
»
Epigenetische Reprogrammierung


|
Gelöschtes Mitglied

|
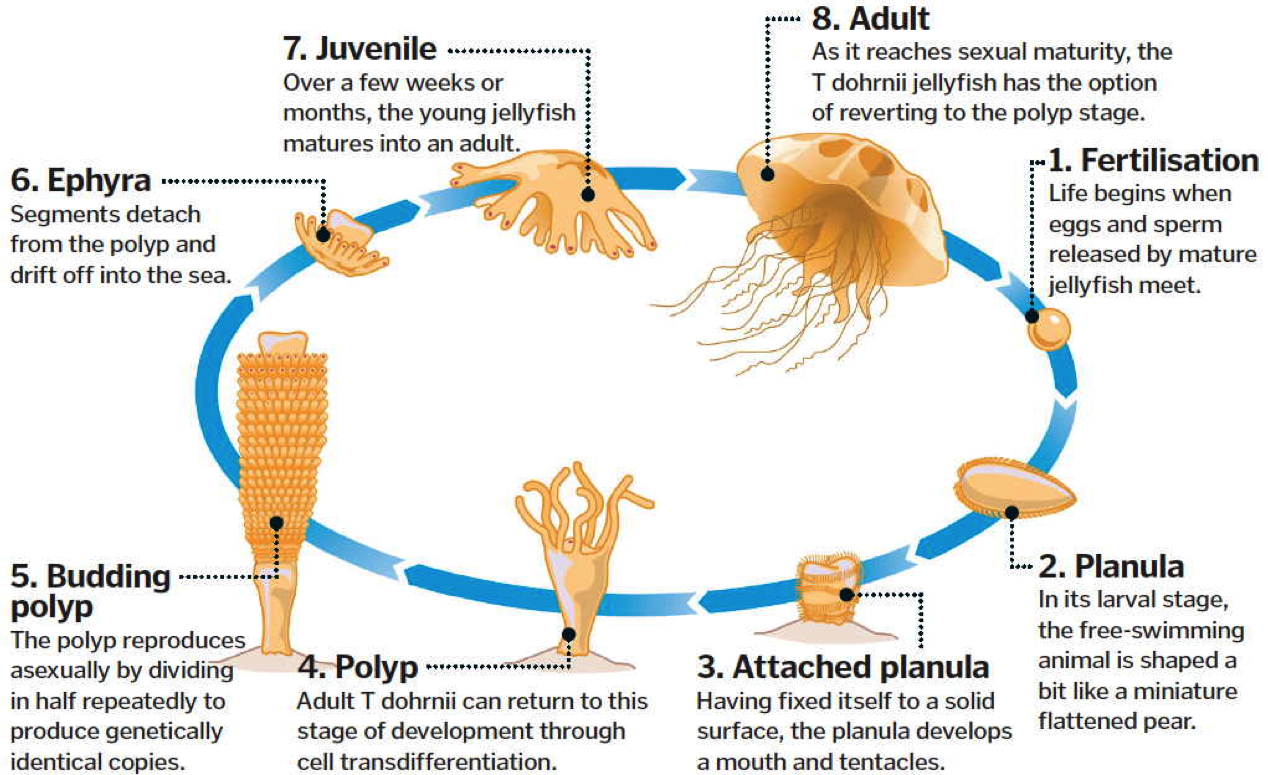
Das Einfachheit halber nenne ich das Tier "Unsterbliche Qualle" (UQ), der wissenschaftliche Name lautet Turritopsis dohrnii. Die UQ kann sich real verjüngen und wieder altern. Damit ist sie der einzig bekannte tierische Organismus, der für uns als Modell für die Unsterblichkeit infrage kommt. Zitat
Zitat
Zitat
Speedy, Tizian und Prometheus haben sich bedankt!
|

|
Gelöschtes Mitglied

|
Hier noch eine neuere Studie: Zitat
Illuminatus, Prometheus und Tizian haben sich bedankt!
|

|
|
Hallo, |

|
|
Zitat von version2 im Beitrag #202 Jain. die Yamanaka-Faktoren sind sowohl in der Keimbahn als auch in der Embryonalentwickllung wichtig - sind sie aktiv, bleiben die Zellen pluripotent. Allerdings gibt es auch eine Expression der Faktoren im adulten Gewebe, dann aber nicht mehr alle Faktoren gleichzeitig, sondern zum Beispiel SOX2 in neuralen Stammzellen und KLF4 in epithelialen Stammzellen. |

|
|
#202 |

|
|
Zitat von Methusalem im Beitrag #205 Vor allem in der G1-Phase des Zellzyklus, in den Gewebs-Stammzellen. Bei undifferenzierten embryonalen Stammzellen sind die Faktoren dauerhaft aktiv. |

|
|
Targeted partial reprogramming of age-associated cell states improves markers of health in mouse models of aging
Prometheus sagt danke
|

|
|
In vivo neuron-specific expression of C. elegans reprogramming factor orthologs does not alleviate age-related cognitive decline |

|
Gelöschtes Mitglied

|
Zitat von Speedy im Beitrag #208 Hab mal nach der Erklärung gesucht: Zitat |

|
|
Modulating DNA Polα Enhances Cell Reprogramming Across Species
Prometheus und Tizian haben sich bedankt!
|

|
Gelöschtes Mitglied

|
‘Yamanaka factors are a biological cheat code’ Zitat
Prometheus und Tizian haben sich bedankt!
|

|
Gelöschtes Mitglied

|
Wobei es schon schön wäre, noch mehr Forschung wie #141 zu sehen. Mit #141 und #143 könnte man sich ja theoretisch vielleicht sogar seine eigene epigenetische Verjüngung basteln (analog zum "Wir haben noch Essen zu Hause" von früher
Prometheus und Tizian haben sich bedankt!
|

|
Gelöschtes Mitglied

|
TL;DR: Könnte man eine einfache epigenetische Verjüngung mit lediglich RepSox, Valproinsäure und Vitamin C erreichen? Zitat
Zitat
Zitat
Zitat
Zitat
Speedy, Prometheus und Tizian haben sich bedankt!
|

|
Gelöschtes Mitglied

|
Hier noch ein Bericht von jemandem, der es u.a. mit Apigenin probiert hat:
Tizian sagt danke
|

|
Gelöschtes Mitglied

|
#214 Die einfachste Variante dazu:
Tizian und Prometheus haben sich bedankt!
|

|
Gelöschtes Mitglied

|
Noch ein paar Stoffe, die man sich anschauen könnte: Glabridin, Licochalcone D, Chrysoeriol (Luteolin-Derivat), Kaempferol, Quercetin, Icaritin (ein Stoff aus der Elfenblume; nicht Icaridin), Glucosamin und Silibinin. Zitat
Zitat
Zitat
Zitat
Zitat
Zitat
Prometheus, Speedy und Tizian haben sich bedankt!
|

|
Gelöschtes Mitglied

|
Conserved Biological Processes in Partial Cellular Reprogramming: A Comprehensive Review Zitat
Speedy, Prometheus und Tizian haben sich bedankt!
|

|
|
Das Folgende habe ich noch mal recherchiert, um es hier zu verewigen: |

|
|
Hallo Prometheus,
Prometheus sagt danke
|

|
|
Hallo,
Tizian sagt danke
|

|
|
Biohacking To Better Health
Illuminatus sagt danke
|

|
|
Expansion of the neocortex and protection from neurodegeneration by in vivo transient reprogramming
Tizian sagt danke
|

|
|
Researchers challenge longstanding theories in cellular reprogramming |

|
Gelöschtes Mitglied

|
Zitat von version2 im Beitrag #215 Hat das mal jemand getestet? Bei mir gings leider noch nicht richtig, aber ich habe die NEMs alle parat. Nur bei meinem nicht-liposomalem Apigenin habe ich Bedenken, weil das alleine genommen keinerlei Effekt zu haben scheint. Kennt ja jemand eine gute Alternative, die ausreichend dosiert ist?
Illuminatus sagt danke
|

 Thema drucken
Thema drucken 20.08.2024 00:21
20.08.2024 00:21
 Antworten
Antworten

 ). Aber ohne wenigstens einen Tierversuch dazu zu sehen, wäre das ein hohes Risiko.
). Aber ohne wenigstens einen Tierversuch dazu zu sehen, wäre das ein hohes Risiko.